Электронное строение бензола. Физические и химические свойства бензола
ОПРЕДЕЛЕНИЕ
Ароматические углеводороды (арены) - вещества, в молекулах которых содержится одно или несколько бензольных колец.
Общая формула гомологического ряда бензола C n H 2 n -6 . Простейшими представителями ароматических углеводородов являются бензол - C 6 H 6 и толуол - C 6 H 5 -CH 3 . Углеводородные радикалы, полученные из аренов носят названия: C 6 H 5 - — фенил (Ph-) и C 6 H 5 -CH 2 — — бензил.
Первые члены гомологического ряда бензола - бесцветные жидкости со специфическим запахом. Они легче водды и в ней практически нерастворимы. Хорошо растворяются в органических растворителях и сами являются хорошими растворителями.
Электронное строение бензолов
Рассмотрим строение ароматических углеводородов на примере молекулы бензола. Это химическое соединение впервые было выделено из продуктов переработки каменного угля в 1825 году, однако, для того, чтобы установить строение его молекулы потребовалось три десятилетия. В 1865 году немец Ф. А. Кекуле высказал идею о том, что атомы углерода в бензоле соединены не в виде открытой цепи, а замкнуты в цикл (рис. 1). По его представлениям молекула бензола - это замкнутый цикл, состоящий из шести атомов углерода с тремя чередующимися двойными связями. Однако Кекуле так и не смог объяснить ряд особых свойств, присущих бензолу: почему бензол не проявляет склонность к реакциям присоединения (не обесцвечивает бромную воду и перманганат калия) несмотря на наличие двойных связей и т.д.
Рис. 1. Строение молекулы бензола по Кекуле.
Согласно представлениям современной органической химии, молекула бензола является правильным плоским шестиугольником. Все шесть атомов углерода находятся в sp 2 -гибридном состоянии. Каждый атом углерода образует σ - связи с двумя атомами углерода и одним атомом водорода, лежащими в плоскости цикла. Валентные углы между тремя σ - связями равны 120 o .
Каждый атом углерода в молекуле бензола имеет одну негибридизованнуюp - орбиталь. Шесть этих орбиталей располагаются перпендикулярно плоскому σ - скелету и параллельно друг другу. При их взаимном перекрывании образуется единое π-электронное облако, т.е. осуществляется круговая делокализация электронов. Наибольшая π-электронная плотность в этой сопряженной системе располагается над плоскостью σ - скелета молекулы и охватывает все шесть атомов углеродного цикла. В результате все связи между атомами углерода в бензоле выравнены и имеют длину 0,139 нм (рис. 2).

Рис. 2. Строение молекулы бензола.
Совокупность свойств бензола называют проявлением ароматического характера, или ароматичности. Явление ароматичности подчиняется правилу Хюккеля, согласно которому ароматические молекулы должны иметь плоский циклический σ - скелет и число обобщенных π-электронов, равное (4n+2), где n = 0, 1, 2, 3 и т.д.
Примеры решения задач
ПРИМЕР 1
| Задание | Плотность паров вещества 3,482 г/л. Его пиролиз дал 6 г сажи и 5,6 л водорода. Определите формулу этого вещества. |
| Решение | Сажа представляет собой углерод. Найдем количество вещества сажи исходя из условий задачи (молярная масса углерода равна 12 г/моль):
n(C) = m(C) / M(C); n(C) = 6 / 12 = 0,5 моль. Рассчитаем количество вещества водорода: n(H 2) = V(H 2) / V m ; n(H 2) = 5,6 / 22,4 = 0,25 моль. Значит, количество вещества одного атома водорода будет равно: n(H) = 2 × 0,25 = 0,5 моль. Обозначим количество атомов углерода в молекуле углеводорода за «х», а количество атомов водорода за «у», тогда соотношение этих атомов в молекуле: х: у = 0,5: 0,5 =1:1. Тогда простейшая формула углеводорода будет выражаться составом СН. Молекулярная масса молекулы состава СН равна: М(СН) = 13 г/моль Найдем молекулярную массу углеводорода исходя из условий задачи: M (C x H y) = ρ×V m ; M (C x H y) = 3,482×22,4 = 78 г/моль. Определим истинную формулу углеводорода: k= M(C x H y)/ М(СН)= 78/13 =6, следовательно, коэффициенты «х» и «у» нужно умножить на 6 и тогда формула углеводорода примет вид C 6 H 6 . Это бензол. |
| Ответ | Искомый углеводород имеет состав C 6 H 6 . Это бензол. |
Цели урока:
- дать понятие об ароматической связи, её особенностях, установить взаимосвязь между строением бензола и его свойствами;
- закрепить умение сравнивать состав и строение углеводородов различных рядов;
- познакомить с физическими свойствами бензола;
- показать токсическое воздействие аренов на здоровье человека.
План лекции
- Вывод молекулярной и структурной формулы бензола.
- История открытия бензола.
- Формула Кекуле.
- Строение бензола.
- Понятие “ароматичности”.
- Возникновение термина “ароматические соединения”.
- Физические свойства бензола.
- Токсическое воздействие аренов на организм человека.
- Закрепление пройденного материала.
- Домашнее задание.
В начале урока предлагаю учащимся решить задачу на вывод формулы вещества.
Задача. При сжигании 2,5 г вещества выделилось 8,46 г углекислого газа и 1,73 г воды. Масса 1 л вещества составляет 3,5 г. Определите молекулярную и возможную структурную формулы вещества.
Решая задачу, учащиеся выводят молекулярную формулу вещества – С 6 Н 6 . Возникает проблемная ситуация: “Какое строение может иметь молекула бензола?” Опираясь на знание о непредельных углеводородах, учащиеся предлагают возможные структурные формулы для него:
НС С-СН 2 -СН 2 - С СН
Н 2 С = СН -С С-СН = СН 2 и другие.
Учащиеся делают вывод о том, что бензол является сильно ненасыщенным соединением, вспоминают качественные реакции на непредельность.
Предлагаю учащимся проверить гипотезу о непредельности бензола в ходе выполнения эксперимента. Проведя реакции бензола с бромной водой и раствором перманганата калия, ученики приходят к выводу, что бензол, являясь ненасыщенной системой, не даёт качественных реакций на непредельность, следовательно, его нельзя отнести к классу непредельных углеводородов.
Какое же строение имеет молекула бензола, и к какому классу углеводородов его можно отнести?
Прежде, чем ответить на этот вопрос, знакомлю учеников с историей открытия бензола, которая весьма интересна. В 1812 – 1815 годах в Лондоне впервые появилось газовое освещение. Светильный газ, добывавшийся из жира морских животных, доставлялся в железных баллонах. Эти баллоны помещались обычно в подвале дома, из них газ по трубкам распределялся по всему помещению. Вскоре было замечено крайне неприятное обстоятельство – в сильные холода газ терял способность давать при горении яркий свет. Владельцы газового завода в 1825 г. обратились за советом к Фарадею, который нашёл, что те составные части, которые способны гореть ярким пламенем, собираются на дне баллона в виде прозрачного жидкого слоя. При исследовании этой жидкости Фарадей открыл новый углеводород – бензол. Название этому веществу дал Либих – (суффикс –ол указывает на его маслянистый характер, от латинского oleum – масло).
В 1865 г. немецким учёным Кекуле была предложена структура молекулы бензола, которая приснилась ему в виде змеи, укусившей себя за хвост:

Но эта формула, соответствуя элементарному составу бензола, не отвечает многим его особенностям:
- бензол не даёт качественных реакций на непредельность;
- для бензола характерны реакции замещения, а не присоединения;
- формула Кекуле не в состоянии объяснить равенства расстояний между углеродными атомами, что имеет место в реальной молекуле бензола.
Чтобы выйти из этого затруднения, Кекуле допустил, что в бензоле происходит непрерывное перемещение двойных связей.

Использование современных физических и квантовых методов исследования дало возможность создать исчерпывающее представление о строении бензола.
Атомы углерода в молекуле бензола находятся во втором валентном состоянии (sp 2). Каждый атом углерода образует -связи с двумя другими атомами углерода и одним атомом водорода, лежащими в одной плоскости. Валентные углы между тремя -связями равны 120°. Таким образом, все шесть атомов углерода лежат в одной плоскости, образуя правильный шестиугольник (рис. 1):

Рис. 1. Схема образования -связей
в молекуле бензола
Каждый атом углерода имеет одну негибридную р-орбиталь. Шесть таких орбиталей располагаются перпендикулярно плоскости -связей и параллельно друг другу (рис. 2). Все шесть р-электронов взаимодействуют между собой, образуя единое -электронное облако. Таким образом, в молекуле бензола осуществляется круговое сопряжение. Наибольшая -электронная плотность в этой сопряженной системе располагается над и под плоскостью кольца (рис. 3):
В результате такого равномерного перекрывания 2р-орбиталей всех шести углеродных атомов происходит “выравнивание” простых и двойных связей – длина связи составляет 0,139 нм. Эта величина является промежуточной между длиной одинарной связи в алканах (0,154 нм) и длиной двойной связи в алкенах (0,133 нм). То есть, в молекуле бензола отсутствуют классические двойные и одинарные связи.
Круговое сопряжение дает выигрыш в энергии 150 кДж/моль. Эта величина составляет энергию сопряжения – количество энергии, которое нужно затратить, чтобы нарушить ароматическую систему бензола.
Такое электронное строение объясняет все особенности бензола. В частности, почему бензол трудно вступает в реакции присоединения – это приводит к нарушению сопряжения. Такие реакции возможны в жёстких условиях.
В настоящее время нет единого способа графического изображения молекулы бензола с учётом его реальных свойств. Но, чтобы подчеркнуть выравненность -электронной плотности в молекуле бензола, прибегают к помощи следующих формул:

Используют и формулу Кекуле, помня при этом о её недостатках.
Совокупность свойств бензола принято называть ароматичностью. В общем виде явление ароматичности было сформулировано немецким физиком Хюккелем: соединение должно проявлять ароматические свойства, если в его молекуле содержится плоское кольцо с (4n+2) -электронами, где n может принимать значения 0, 1, 2, 3 и т. д. Согласно этому правилу, системы, содержащие 6, 10, 14 -электронов, являются ароматическими.
Примерами таких соединений являются нафталин (n=2) и антрацен (n=3).
После рассмотрения строения бензола с учащимися обсуждаем ответы на вопросы:
- Можно ли отнести бензол к непредельным углеводородам? Ответ обоснуйте.
- К какому классу углеводородов относится бензол?
- Что подразумевается под понятием “ароматическое соединение”?
- Какие углеводороды называются ароматическими?
Далее знакомлю учащихся с происхождением термина “ароматические соединения”. Сообщаю, что это название возникло в начальный период развития химии. Было замечено, что соединения бензольного ряда получаются при перегонке некоторых приятно пахнущих (ароматических) веществ – природных смол и бальзамов. Однако большинство ароматических соединений не имеют запаха или пахнут неприятно. Но данный термин сохранился в химии. Ароматическими углеводородами (аренами) называются вещества, в молекулах которых содержится одно или несколько бензольных колец – циклических групп атомов углерода с особым характером связей.
Далее учащиеся знакомятся с физическими свойствами бензола, работая с учебной литературой. Им известно, что бензол – это жидкость, может находиться и в парообразном состоянии (при исследовании запаха). Знакомлю учащихся с бензолом в твёрдом виде. Температура плавления бензола 5,5°С. Основываясь на этом сведении, демонстрирую превращение жидкого бензола в белую кристаллическую массу. Для этого 4-5 мл бензола, находящегося в пробирке, опускаю в сосуд, наполненный снегом или льдом. Через несколько минут учащиеся наблюдают изменение агрегатного состояния бензола. На основании наблюдений учащиеся высказывают предположение о том, что у этого вещества должна быть молекулярная кристаллическая решетка.
Обращаю внимание учащихся на то, что бензол является сильно токсичным веществом. Вдыхание его паров вызывает головокружение и головную боль. При высоких концентрациях бензола возможны случаи потери сознания. Его пары раздражают глаза и слизистую оболочку.
Жидкий бензол легко проникает в организм через кожу, что может привести к отравлению. Поэтому работа с бензолом и его гомологами требует особой осторожности.
Материал темы “Бензол” использую для объяснения вреда курения. Исследования дёгтеобразного вещества, полученного из табачного дыма показали, что в нём содержатся, помимо никотина, ароматические углеводороды типа бензпирена,

обладающие сильными канцерогенными свойствами, т. е. эти вещества действуют как возбудители рака. Табачный дёготь при попадании на кожу и в лёгкие вызывает образование раковых опухолей. Курильщики чаще заболевают раком губы, языка, гортани, пищевода. Они намного чаще страдают стенокардией, инфарктом миокарда. Отмечаю, что около 50% ядовитых веществ курильщик выделяет в окружающее пространство, создавая вокруг себя кольцо “пассивных курильщиков”, у которых быстро появляется головная боль, тошнота, общее недомогание, а затем могут развиваться и хронические заболевания.
В конце урока провожу фронтальный опрос по вопросам:


Домашнее задание : стр.55-58, стр. 61 №1, 2 по учебнику Э. Е. Нифантьева, Л. А. Цветкова “Химия 10-11”.
Ароматические УВ (арены) – это УВ, молекулы которых содержат одно или несколько бензольных колец.
Примеры ароматических УВ:

Арены ряда бензола (моноциклические арены)
Общая формула: C n H 2n-6 , n≥6
Простейшим представителем ароматических УВ является бензол, его эмпирическая формула С 6 Н 6 .
Электронное строение молекулы бензола
Общая формула моноциклических аренов C n H 2 n -6 показывает, что они являются ненасыщенными соединениями.
В 1856 г. немецкий химик А.Ф. Кекуле предложил циклическую формулу бензола с сопряженными связями (чередуются простые и двойные связи) - циклогексатриен-1,3,5:
Такая структура молекулы бензола не объясняла многие свойства бензола:
- для бензола характерны реакции замещения, а не реакции присоединения, свойственные ненасыщенным соединениям. Реакции присоединения возможны, но протекают труднее, чем для ;
- бензол не вступает в реакции, являющиеся качественными реакциями на непредельные УВ (с бромной водой и раствором КМnО 4).
Проведенные позже электронографические исследования показали, что все связи между атомами углерода в молекуле бензола имеют одинаковую длину 0,140 нм (среднее значение между длиной простой связи С-С 0,154 нм и двойной связи С=С 0,134 нм). Угол между связями у каждого атома углерода равен 120 о. Молекула представляет собой правильный плоский шестиугольник.
Современная теория для объяснения строения молекулы С 6 Н 6 использует представление о гибридизации орбиталей атома .
Атомы углерода в бензоле находятся в состоянии sp 2 -гибридизации. Каждый атом «С» образует три σ-связи (две с атомами углерода и одну с атомом водорода). Все σ-связи находятся в одной плоскости:
Каждый атом углерода имеет один р-электрон, который не участвует в гибридизации. Негибридизованные р-орбитали атомов углерода находятся в плоскости, перпендикулярной плоскости σ-связей. Каждое р-облако перекрывается с двумя соседними р-облаками, и в результате образуется единая сопряженная π-система (вспомните эффект сопряжения р-электронов в молекуле бутадиена-1,3, рассмотренный в теме «Диеновые углеводороды»):
Сочетание шести σ-связей с едиой π-системой называется ароматической связью.
Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом, или бензольным ядром .
В соответствии с современными представлениями об электронном строении бензола молекулу С 6 Н 6 изображают следующим образом:

Физические свойства бензола
Бензол при обычных условиях - бесцветная жидкость; t o пл = 5,5 о С; t o кип. = 80 о С; имеет характерный запах; не смешивается с водой, хороший растворитель, сильно токсичен.
Химические свойства бензола
Ароматическая связь определяет химические свойства бензола и других ароматических УВ.
6π-электронная система является более устойчивой, чем обычные двухэлектроиные π-связи. Поэтому реакции присоединения менее характерны для ароматических УВ, чем для непредельных УВ. Наиболее характерными для аренов являются реакции замещения.
I . Реакции замещения
1.Галогенирование

2. Нитрование
Реакцию осуществляют смесью и кислот (нитрующая смесь):
3.Сульфирование

4.Алкилирование (замещение атома «Н» на алкильную группу) – реакции Фриделя-Крафтса , образуются гомологи бензола:

Вместо галогеналканов можно использовать алкены (в присутствии катализатора – AlCl 3 или неорганической кислоты):

II . Реакции присоединения
1.Гидрирование

2.Присоединение хлора

III. Реакции окисления
1. Горение
2С 6 Н 6 + 15О 2 → 12СО 2 + 6Н 2 О
2. Неполное окисление (KMnO 4 или K 2 Cr 2 O 7 в кислой среде). Бензольное кольцо устойчиво к действию окислителей. Реакция не происходит.
Получение бензола
В промышленности:
1) переработка нефти и угля;
2) дегидрирование циклогексана:

3) дегидроциклизация (ароматизация) гексана:

В лаборатории:
Сплавление солей бензойной кислоты со :

Изомерия и номенклатура гомологов бензола
Любой гомолог бензола имеет боковую цепь, т.е. алкильные радикалы, связанные с бензольным ядром. Первый гомолог бензола представляет собой бензольное ядро, связанное с метильным радикалом:
Толуол не имеет изомеров, поскольку все положения в бензольном ядре равноценны.
Для последующих гомологов бензола возможен один вид изомерии – изомерия боковой цепи, которая может быть двух видов:
1) изомерия числа и строения заместителей;
2) изомерия положения заместителей.



Физические свойства толуола
Толуол - бесцветная жидкость с характерным запахом, не растворимая в воде, хорошо растворяется в органических растворителях. Толуол менее токсичен, чем бензол.
Химические свойства толуола
I . Реакции замещения
1.Реакции с участием бензольного кольца
Метилбензол вступает во все реакции замещения, в которых участвует бензол, и проявляет при этом более высокую реакционную способность, реакции протекают с большей скоростью.
Метильный радикал, содержащийся в молекуле толуола, является заместителем рода, поэтому в результате реакций замещения в бензольном ядре получаются орто- и пара-производные толуола или при избытке реагента - трипроизводные общей формулы:

а) галогенирование


При дальнейшем хлорировании можно получить дихлорметилбензол и трихлорметилбензол:

II . Реакции присоединения
Гидрирование

III. Реакции окисления
1.Горение
C 6 H 5 CH 3 + 9O 2 → 7CO 2 + 4H 2 O
2. Неполное окисление
В отличие от бензола его гомологи окисляются некоторыми окислителями; при этом окислению подвергается боковая цепь, в случае толуола – метильная группа. Мягкие окислители типа MnO 2 окисляют его до альдегидной группы, более сильные окислители (KMnO 4) вызывают дальнейшее окисление до кислоты:
Любой гомолог бензола с одной боковой цепью окисляется сильным окислителем типа KMnO4 в бензойную кислоту, т.е. происходит разрыв боковой цепи с окислением отщепившейся части ее до СО 2 ; например:
При наличии нескольких боковых цепей каждая из них окисляется до карбоксильной группы и в результате образуются многоосновные кислоты, например:

Получение толуола:
В промышленности:
1) переработка нефти и угля;
2) дегидрирование метилциклогексана:

3) дегидроциклизация гептана:
В лаборатории:
1) алкилирование по Фриделю-Крафтсу;
2) реакция Вюрца-Фиттига (взаимодействие натрия со смесью галогенбензола и галогеналкана).
Строение бензола
Бензол впервые был выделен М. Фарадеем в 1825 году из конденсата, выпавшего из светильного газа, используемого для освещения городских улиц Лондона. Фарадей назвал это жидкое легкоподвижное вещество с резким запахом «карбюрированным водородом» (carburated hydrogen). Важно при этом отметить, что уже тогда было установлено, что бензол состоит из равных частей углерода и водорода.
Несколько позже, в 1834 году, Митчерлих получил бензол декарбоксилированием бензойной кислоты. Он же установил элементный состав полученного соединения – С 6 Н 6 – и предложил свое название для него – бензин . Однако с этим названием не согласился Либих. Ему показалось, что это название ставит бензол в один ряд с такими далекими от него веществами как хинин и стрихнин. По мнению Либиха более удачным названием для нового соединения является бензол , посколькуоно показывает близость бензола по свойствам к маслам (от немецкого оl – масло). Были и другие предложения. Поскольку бензол был выделен Фарадеем из светильного газа, то Лоран предложил (1837 г.) для него название фено от греческого «несущий свет». Это название не утвердилось, однако именно от него произошло название одновалентного остатка бензола – фенил .
Углеводороду Фарадея не повезло. Все предложенные для него названия оказались ущербными. Из либиховского названия «бензол» следует, что соединение содержит гидроксильную группу, которой там нет. Точно так же митчерлиховский «бензин» не содержит функциональную азотсодержащую группу. Более того, существование различных названий привело к разделению химиков. В немецкой и русской научной литературе утвердилось название «бензол», а в английской и французской – «бензен» (bensene , toluene , xylene ).
На первый взгляд кажется, что установить строение бензола не представляет больших трудностей. В состав молекулы бензола входит лишь два элемента, на шесть атомов углерода приходится шесть атомов водорода. К тому же физические и химические свойства бензола изучены весьма обстоятельно. Однако эта работа затянулась на многие десятилетия и завершилась лишь в 1931 году.
Наиболее трудные барьеры к познанию структуры бензола были преодолены выдающимся немецким химиком Кекуле. С высоты современных знаний трудно понять и оценить значение выдвинутой им гипотезы, согласно которой молекула бензола имеет циклическое строение (1865 г.). Однако именно это предположение, при совокупном рассмотрении с числом изомеров у моно- и дизамещенных бензолов, привело Кекуле к известной формуле. По Кекуле бензол представляет собой шестичленное циклическое соединение с тремя чередующимися двойными связями, т.е. циклогексатриен
Именно эта структура согласуется с существованием одного и только одного монозамещенного бензола и трех изомеров дизамещенных бензолов

C момента появления структуры Кекуле началась ее критика, которую она, к сожалению, вполне заслуживала. Уже отмечалось, что характерная особенность ароматических соединений - присущий им ароматический характер. Структура Кекуле для бензола оказалась не в состоянии объяснить эту особенность ароматических соединений. В ряде случаев она не могла также объяснить отсутствия изомеров, в то время как формула циклогексатриена для бензола допускала их существование. Так, орто -замещенных бензолов может быть два изомера

однако обнаружить их не удалось. Сразу же отметим, что для преодоления этого затруднения Кекуле предложил рассматривать бензол как циклогексатриен с подвижными, не закрепленными, двойными связями. В результате быстрого преобразования I во II и наоборот бензол ведет себя как структура как бы состоящая из равных количеств I и II .
Итак, основной недостаток бензола Кекуле – невозможность объяснить на его основе ароматический характер соединений, содержащих в своей молекуле бензольное кольцо. Если бы бензол был циклогексатриеном, т.е. соединением с тремя двойными связями, то он должен был бы:
Легко окисляться даже холодным водным раствором КMnO 4 ,
Уже при комнатной температуре присоединять бром и легко вступать в другие реакции электрофильного присоединения,
Быстро гидрироваться водородом в присутствии никеля при комнатной температуре,
В эти реакции бензол вступает неохотно, не так как алкены. А вот реакции замещения - весьма характерны для соединений ароматического ряда. Отсюда следует, что бензол не может быть циклогексатриеном и формула Кекуле не отражает истинного строения бензола . Основной недостаток бензола Кекуле – присутствие в нем двойных связей. Если бы их не было, то и не следовало бы ожидать от бензола проявления свойств, характерных для алкенов. В этой связи становится понятным, почему все дальнейшие попытки «усовершенствовать» формулу Кекуле носили форму лишить ее двойных связей, сохранив при этом за бензолом циклическое строение. Таковы формулы III – VII , предложенные Клаусом (1867 г.), Дьюаром (1867 г.), Армстронгом – Байером (1887 г.), Тиле (1899 г.) и Ладенбургом (1869 г.)

Ни одна из этих формул не могла объяснить всех свойств, присущих бензолу. Это стало возможным только с развитием квантовой химии.
Согласно современным представлениям о строении бензола его молекула представляет собой плоский правильный шестиугольник, на вершинах которого расположены углеродные атомы, находящиеся в sp 2 –гибридном состоянии. Каждый из шести углеродных атомов за счет трех тригональных гибридных орбиталей образует две σ -связи с соседними углеродами и еще одну связь с водородом. Все эти связи расположены в одной плоскости под углом 120 0 друг к другу. В гибридизации участвуют лишь два из трех р -электронов углеродных атомов. Поэтому после образования σ -связей у каждого из шести углеродов бензольного кольца остается еще по одному р -электрону. Из истории установления строения бензола, растянувшегося на многие десятилетия, видно насколько трудно пробивало себе дорогу представление, что р -электроны способны перекрываться друг с другом не только попарно с образованием π -связей. При некоторых обстоятельствах возможно перекрывание облаков р- электронов как с соседом справа, так и с соседом слева

Это становится возможным, если молекула имеет циклическое строение, расстояния между углеродами одинаковы и оси р -электронов параллельны между собой. Последнее условие соблюдается, если молекула имеет плоское строение.
При таком построении молекулы бензола углеродные атомы связаны между собой не ординарными и не двойными связями. Эти связи, скорее всего, следовало бы отнести к «полуторным». Не лишним будет упомянуть, что согласно результатам рентгеноструктурного анализа кристаллического бензола все углерод-углеродные связи в бензоле имеют одинаковую длину 0.14 нм, которая является промежуточной между простой (0,154 нм) и двойной (0,134 нм) связями.
Таким образом, согласно современным представлениям в бензоле нет типичных двойных связей между углеродами. Следовательно, от такого соединения и не следует ожидать проявления свойств, обусловленных двойными связями. В то же время нельзя отрицать значительной непредельности молекулы бензола. Циклоалкан с шестью углеродами (циклогексан) содержит 12 водородных атомов, в то время как у бензола их всего 6. Отсюда следует, что формально бензол мог бы иметь три двойные связи и в реакциях присоединения вести себя как циклотриен. Действительно, в условиях реакций присоединения бензол присоединяет по три молекулы водорода, галогенов или озона.
В настоящее время в научно-технической литературе используется два графических изображения бензола

Одно из них подчеркивает непредельный характер бензола, а другое – его ароматичность.
Как же увязать строение бензола с его характерными свойствами, главным образом, с его ароматическим характером? Почему бензол проявляет уникальную термодинамическую устойчивость?
В свое время было показано, что алкены довольно легко присоединяют молекулу водорода и превращаются в алканы. Эта реакция протекает с выделением тепла, около 125,61 кДж на каждую двойную связь, и носит название - теплоты гидрирования. Попробуем использовать теплоту гидрирования для оценки термодинамической устойчивости бензола.
Реально существующие циклогексен, циклогексадиен и бензол гидрируются в циклогексан

Теплота гидрирования циклогексена составила 119,75 кДж. Тогда ожидаемое значение для циклогексадиена должно составить 119,75 х 2=239,50 кДж (в действительности 231,96 кДж). Если бы бензол имел три двойные связи (циклогексатриен Кекуле), то теплота гидрирования для него должна была бы быть 119,75 х 3=359,25 кДж. Экспериментальное же значение в последнем случае разительно отличается от ожидаемого. При гидрировании бензола выделяется лишь 208.51 кДж тепла, что меньше ожидаемого значения на 359,25 – 208.51=150,73 кДж. Эта энергия носит название энергии резонанса . Если при гидрировании бензола выделяется на 150,73 кДж меньше энергии от ожидаемого значения, то это означает лишь то, что сам бензол уже изначально содержит на 150,73 кДж меньше энергии, чем гипотетический циклогексатриен. Отсюда следует, что бензол не может иметь строения циклогексатриена. Стабильность молекулы бензола на величину энергии резонанса есть результат отсутствия в ней изолированных двойных связей и наличия единого электронного облака секстета р -электронов.
Приобретая благодаря выгодам своего строения высокую термодинамическую устойчивость, бензол в ходе химических реакций всячески стремится сохранить эту устойчивость. Понятно, что это может быть реализовано только при условии сохранения при химической реакции бензольного кольца в неизменном виде. Такую возможность предоставляют лишь реакции замещения и именно по этой причине для соединений ароматического ряда более характерны реакции замещения, чем присоединения. В ходе реакций электрофильного присоединения ароматическое соединение перестает быть ароматическим, теряет исключительную стабильность вместе с энергией резонанса, обуславливающей как раз эту стабильность. По этой причине ароматические соединения вступают в реакции присоединения гораздо труднее, чем, например, алкены. Другая особенность реакций присоединения с участием ароматических соединений – это их бескомпромиссность. Они либо не вступают в реакции присоединения, либо присоединяют сразу все. Об этом свидетельствует тот факт, что не удается получить из бензола продукты частичного гидрирования или хлорирования. Если уже эти реакции идут, то протекают таким образом, что сразу получаются продукты полного гидрирования или хлорирования

Такое развитие событий связано с тем, что единое электронное облако шести р -электронов у бензола или существует или не существует, промежуточные варианты для него исключены.
Первая группа реакций реакции замещения. Мы говорили, что арены не имеют кратных связей в структуре молекулы, а содержат сопряженную систему из шести электронов, которая очень стабильна и придает дополнительную прочность бензольному кольцу. Поэтому в химических реакциях происходит в первую очередь замещение атомов водорода, а не разрушение бензольного кольца.
С реакциями замещения мы уже сталкивались при разговоре об алканах , но для них эти реакции шли по радикальному механизму, а для аренов характерен ионный механизм реакций замещения.
Первое химическое свойство галогенирование. Замещение атома водорода на атом галогена хлора или брома.
Реакция идет при нагревании и обязательно с участием катализатора. В случае с хлором это может быть хлорид алюминия или хлорид железа три. Катализатор поляризует молекулу галогена, в результате чего происходит гетеролитический разрыв связи и получаются ионы.
Положительно заряженный ион хлора и вступает в реакцию с бензолом.
Если реакция происходит с бромом, то катализатором выступает бромид железа три или бромид алюминия.

Важно отметить, что реакция происходит с молекулярным бромом, а не с бромной водой. С бромной водой бензол не реагирует.
У галогенирования гомологов бензола есть свои особенности. В молекуле толуола метильная группа облегчает замещение в кольце, реакционная способность повышается, и реакция идет в более мягких условиях, то есть уже при комнатной температуре.

Важно отметить, что замещение всегда происходит в орто- и пара-положениях, поэтому получается смесь изомеров.
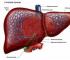
Второе свойство нитрование бензола, введение нитрогруппы в бензольное кольцо.
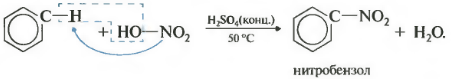
Образуется тяжелая желтоватая жидкость с запахом горького миндаля нитробензол, поэтому реакция может быть качественной на бензол. Для нитрования используется нитрующая смесь концентрированной азотной и серной кислот. Реакция проводится при нагревании.
Напомню, что для нитрования алканов в реакции Коновалова использовалась разбавленная азотная кислота без добавления серной.
При нитровании толуола, также как и при галогенировании, образуется смесь орто- и пара- изомеров.
Третье свойство алкилирование бензола галогеналканами.

Эта реакция позволяет ввести углеводородный радикал в бензольное кольцо и может считаться способом получения гомологов бензола. В качестве катализатора используется хлорид алюминия, способствующий распаду молекулы галогеналкана на ионы. Также необходимо нагревание.
Четвертое свойство алкилирование бензола алкенами.

Таким способом можно получить, например, кумол или же этилбензол. Катализатор хлорид алюминия.
2. Реакции присоединения к бензолу
Вторая группа реакций реакции присоединения. Мы говорили, что эти реакции не характерны, но они возможны при достаточно жестких условиях с разрушением пи-электронного облака и образованием шести сигма-связей.
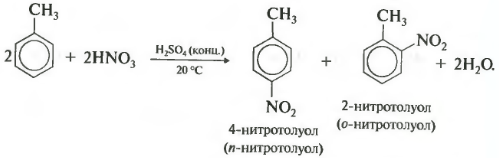
Пятое свойство в общем списке гидрирование, присоединение водорода.
Температура, давление, катализатор никель или платина. Таким же образом способен реагировать толуол.
Шестое свойство хлорирование. Обратите внимание, что речь идет именно о взаимодействии с хлором, поскольку бром в эту реакцию не вступает.

Реакция протекает при жестком ультрафиолетовом облучении. Образуется гексахлорциклогексан, другое название гексахлоран, твердое вещество.
Важно помнить, что для бензола не возможны реакции присоединения галогеноводородов (гидрогалогенирование) и присоединение воды (гидратация).
3. Замещение в боковой цепи гомологов бензола
Третья группа реакций касается только гомологов бензола это замещение в боковой цепи.
Седьмое свойство в общем списке галогенирование по альфа-атому углерода в боковой цепи.
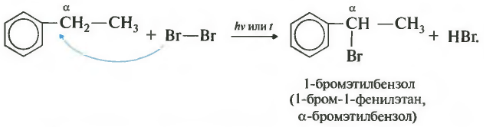
Реакция происходит при нагревании или облучении и всегда только по альфа-углероду. При продолжении галогенирования, второй атом галогена снова встанет в альфа-положение.
4. Окисление гомологов бензола
Четвертая группа реакций окисление.
Бензольное кольцо слишком прочное, поэтому бензол не окисляется перманганатом калия не обесцвечивает его раствор. Это очень важно помнить.
Зато гомологи бензола окисляются подкисленным раствором перманганата калия при нагревании. И это восьмое химическое свойство.

Получается бензойная кислота. Наблюдается обесцвечивание раствора. При этом, какой бы длинной не была углеродная цепь заместителя, всегда происходит ее разрыв после первого атома углерода и альфа-атом окисляется до карбоксильной группы с образованием бензойной кислоты. Оставшаяся часть молекулы окисляется до соответствующий кислоты или, если это только один атом углерода, до углекислого газа.
Если гомолог бензола имеет больше одного углеводородного заместителя у ароматического кольца, то окисление происходит по тем же правилам окисляется углерод, находящийся в альфа-положении.

В данном примере получается двухосновная ароматическая кислота, которая называется фталевая кислота.
Особым образом отмечу окисление кумола, изопропилбензола, кислородом воздуха в присутствии серной кислоты.

Это так называемый кумольный способ получения фенола. Как правило, сталкиваться с этой реакцией приходится в вопросах, касающихся получения фенола. Это промышленный способ.
Девятое свойство горение, полное окисление кислородом. Бензол и его гомологи сгорают до углекислого газа и воды.
Запишем уравнение горения бензола в общем виде.
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле арена, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO 2 . Молекул воды будет в два раза меньше, чем атомов водорода, то есть (2n-6)/2, а значит n-3.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n-3 из воды, итого 3n-3. Слева атомов кислорода столько же 3n-3, а значит молекул в два раза меньше, потому как в состав молекулы входят два атома. То есть (3n-3)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания гомологов бензола в общем виде.