Формула этиленгликоля структурная химическая. Токсичность этиленгликоля при отравлении
Этиленглико́ль (гликоль ; 1,2-диоксиэтан ; этандиол-1,2 ), HO-CH 2 -CH 2 -OH - двухатомный спирт, простейший представитель полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу.
История открытий и производства
Этиленгликоль впервые был получен в 1859 году французским химиком Вюрцем из диацетата этиленгликоля омылением гидроксидом калия и в 1860-м гидратацией этиленоксида . Он не находил широкого применения до Первой мировой войны , когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ. В США полупромышленное производство начато в 1917 году через этиленхлоргидрин . Первое крупномасштабное производство начато с возведением завода в 1925 году около Саут Чарлстона (Западная Вирджиния , США) компанией «Carbide and Carbon Chemicals Co.» (англ.). К 1929 году этиленгликоль использовался практически всеми производителями динамита .
В 1937 компания Carbide начала первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида . Монополия компании Carbide на данный процесс продолжалась до 1953 года.
Получение
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190-200°С или при 1 атм и 50-100°С в присутствии 0,1-0,5 % серной или ортофосфорной кислоты, достигая 90 % выхода. Побочными продуктами при этом являются диэтиленгликоль , триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Применение
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей , что составляет 60 % его потребления. Смесь 60 % этиленгликоля и 40 % воды замерзает при −49 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- Используется как теплоноситель с содержанием не более 50 % в системах отопления (частные дома в основном)
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
- В производстве целлофана , полиуретанов и ряда других полимеров . Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
- в качестве высокотемпературного растворителя.
- для защиты карбонильной группы путём получения 1,3-диоксолана . Обработкой вещества с карбонильной группой в бензоле или толуоле этиленгликолем в присутствии кислого катализатора (толуолсульфоновой кислоты , BF 3 Et 2 O и др.) и азеотропной отгонкой на насадке Дина-Старка образующейся воды. Например, защита карбонильной группы изофорона
 1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана или комплекса диметилсульфат -ДМФА
1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана или комплекса диметилсульфат -ДМФА
1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
- Как компонент жидкости «И», используемой для предотвращения обводнения авиационных топлив.
- В качестве криопротектора
- Для поглощения воды, для предотвращения образования гидрата метана (ингибитор гидратообразования), который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенерируют путём осушения и удаления солей.
- Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля .
Этиленгликоль также применяется:
- при производстве конденсаторов
- при производстве 1,4-диоксана
- как теплоноситель в системах чиллер-фанкойл
- в качестве компонента крема для обуви (1-2 %)
- в составе для мытья стёкол вместе с изопропиловым спиртом
- при криоконсрвировании биологических объектов (в крионике) в качестве криопротектора.
Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция , сульфатом натрия , +I 2 , фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом . Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
Меры безопасности
Этиленгликоль - горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний - 112, верхний - 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8- 6,4 % (по объему).
Этиленгликоль токсичен. По степени воздействия на организм относится к веществам 3-го класса опасности.
Летальная доза при однократном пероральном употреблении составляет 100-300 мл этиленгликоля (1,5-5мл на 1 кг массы тела) . Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол .
В организме метаболизируется путём окисления до альдегида гликолевой кислоты и далее до гликолевой кислоты, которая затем распадается до муравьиной кислоты и диоксида углерода. Также он частично окисляется до щавелевой кислоты, которая вызывает повреждения почечной ткани. Этиленгликоль и его метаболиты выводятся из организма с мочой .
См. также
Напишите отзыв о статье "Этиленгликоль"
Примечания
Ссылки
- (рус.)
- - Chemical Society Reviews. Issue 11, 2012, 41, 4218-4244. DOI: 10.1039/C2CS15359A
Отрывок, характеризующий Этиленгликоль
– Я, я, я не думал; впрочем я никогда не обещался, потому что…Пьер перебил его. – Есть у вас письма ее? Есть у вас письма? – повторял Пьер, подвигаясь к Анатолю.
Анатоль взглянул на него и тотчас же, засунув руку в карман, достал бумажник.
Пьер взял подаваемое ему письмо и оттолкнув стоявший на дороге стол повалился на диван.
– Je ne serai pas violent, ne craignez rien, [Не бойтесь, я насилия не употреблю,] – сказал Пьер, отвечая на испуганный жест Анатоля. – Письма – раз, – сказал Пьер, как будто повторяя урок для самого себя. – Второе, – после минутного молчания продолжал он, опять вставая и начиная ходить, – вы завтра должны уехать из Москвы.
– Но как же я могу…
– Третье, – не слушая его, продолжал Пьер, – вы никогда ни слова не должны говорить о том, что было между вами и графиней. Этого, я знаю, я не могу запретить вам, но ежели в вас есть искра совести… – Пьер несколько раз молча прошел по комнате. Анатоль сидел у стола и нахмурившись кусал себе губы.
– Вы не можете не понять наконец, что кроме вашего удовольствия есть счастье, спокойствие других людей, что вы губите целую жизнь из того, что вам хочется веселиться. Забавляйтесь с женщинами подобными моей супруге – с этими вы в своем праве, они знают, чего вы хотите от них. Они вооружены против вас тем же опытом разврата; но обещать девушке жениться на ней… обмануть, украсть… Как вы не понимаете, что это так же подло, как прибить старика или ребенка!…
Пьер замолчал и взглянул на Анатоля уже не гневным, но вопросительным взглядом.
– Этого я не знаю. А? – сказал Анатоль, ободряясь по мере того, как Пьер преодолевал свой гнев. – Этого я не знаю и знать не хочу, – сказал он, не глядя на Пьера и с легким дрожанием нижней челюсти, – но вы сказали мне такие слова: подло и тому подобное, которые я comme un homme d"honneur [как честный человек] никому не позволю.
Пьер с удивлением посмотрел на него, не в силах понять, чего ему было нужно.
– Хотя это и было с глазу на глаз, – продолжал Анатоль, – но я не могу…
– Что ж, вам нужно удовлетворение? – насмешливо сказал Пьер.
– По крайней мере вы можете взять назад свои слова. А? Ежели вы хотите, чтоб я исполнил ваши желанья. А?
– Беру, беру назад, – проговорил Пьер и прошу вас извинить меня. Пьер взглянул невольно на оторванную пуговицу. – И денег, ежели вам нужно на дорогу. – Анатоль улыбнулся.
Это выражение робкой и подлой улыбки, знакомой ему по жене, взорвало Пьера.
– О, подлая, бессердечная порода! – проговорил он и вышел из комнаты.
На другой день Анатоль уехал в Петербург.
Пьер поехал к Марье Дмитриевне, чтобы сообщить об исполнении ее желанья – об изгнании Курагина из Москвы. Весь дом был в страхе и волнении. Наташа была очень больна, и, как Марья Дмитриевна под секретом сказала ему, она в ту же ночь, как ей было объявлено, что Анатоль женат, отравилась мышьяком, который она тихонько достала. Проглотив его немного, она так испугалась, что разбудила Соню и объявила ей то, что она сделала. Во время были приняты нужные меры против яда, и теперь она была вне опасности; но всё таки слаба так, что нельзя было думать везти ее в деревню и послано было за графиней. Пьер видел растерянного графа и заплаканную Соню, но не мог видеть Наташи.
Пьер в этот день обедал в клубе и со всех сторон слышал разговоры о попытке похищения Ростовой и с упорством опровергал эти разговоры, уверяя всех, что больше ничего не было, как только то, что его шурин сделал предложение Ростовой и получил отказ. Пьеру казалось, что на его обязанности лежит скрыть всё дело и восстановить репутацию Ростовой.
Он со страхом ожидал возвращения князя Андрея и каждый день заезжал наведываться о нем к старому князю.
Князь Николай Андреич знал через m lle Bourienne все слухи, ходившие по городу, и прочел ту записку к княжне Марье, в которой Наташа отказывала своему жениху. Он казался веселее обыкновенного и с большим нетерпением ожидал сына.
Чрез несколько дней после отъезда Анатоля, Пьер получил записку от князя Андрея, извещавшего его о своем приезде и просившего Пьера заехать к нему.
Князь Андрей, приехав в Москву, в первую же минуту своего приезда получил от отца записку Наташи к княжне Марье, в которой она отказывала жениху (записку эту похитила у княжны Марьи и передала князю m lle Вourienne) и услышал от отца с прибавлениями рассказы о похищении Наташи.
Князь Андрей приехал вечером накануне. Пьер приехал к нему на другое утро. Пьер ожидал найти князя Андрея почти в том же положении, в котором была и Наташа, и потому он был удивлен, когда, войдя в гостиную, услыхал из кабинета громкий голос князя Андрея, оживленно говорившего что то о какой то петербургской интриге. Старый князь и другой чей то голос изредка перебивали его. Княжна Марья вышла навстречу к Пьеру. Она вздохнула, указывая глазами на дверь, где был князь Андрей, видимо желая выразить свое сочувствие к его горю; но Пьер видел по лицу княжны Марьи, что она была рада и тому, что случилось, и тому, как ее брат принял известие об измене невесты.
– Он сказал, что ожидал этого, – сказала она. – Я знаю, что гордость его не позволит ему выразить своего чувства, но всё таки лучше, гораздо лучше он перенес это, чем я ожидала. Видно, так должно было быть…
– Но неужели совершенно всё кончено? – сказал Пьер.
Княжна Марья с удивлением посмотрела на него. Она не понимала даже, как можно было об этом спрашивать. Пьер вошел в кабинет. Князь Андрей, весьма изменившийся, очевидно поздоровевший, но с новой, поперечной морщиной между бровей, в штатском платье, стоял против отца и князя Мещерского и горячо спорил, делая энергические жесты. Речь шла о Сперанском, известие о внезапной ссылке и мнимой измене которого только что дошло до Москвы.
– Теперь судят и обвиняют его (Сперанского) все те, которые месяц тому назад восхищались им, – говорил князь Андрей, – и те, которые не в состоянии были понимать его целей. Судить человека в немилости очень легко и взваливать на него все ошибки другого; а я скажу, что ежели что нибудь сделано хорошего в нынешнее царствованье, то всё хорошее сделано им – им одним. – Он остановился, увидав Пьера. Лицо его дрогнуло и тотчас же приняло злое выражение. – И потомство отдаст ему справедливость, – договорил он, и тотчас же обратился к Пьеру.
– Ну ты как? Все толстеешь, – говорил он оживленно, но вновь появившаяся морщина еще глубже вырезалась на его лбу. – Да, я здоров, – отвечал он на вопрос Пьера и усмехнулся. Пьеру ясно было, что усмешка его говорила: «здоров, но здоровье мое никому не нужно». Сказав несколько слов с Пьером об ужасной дороге от границ Польши, о том, как он встретил в Швейцарии людей, знавших Пьера, и о господине Десале, которого он воспитателем для сына привез из за границы, князь Андрей опять с горячностью вмешался в разговор о Сперанском, продолжавшийся между двумя стариками.
– Ежели бы была измена и были бы доказательства его тайных сношений с Наполеоном, то их всенародно объявили бы – с горячностью и поспешностью говорил он. – Я лично не люблю и не любил Сперанского, но я люблю справедливость. – Пьер узнавал теперь в своем друге слишком знакомую ему потребность волноваться и спорить о деле для себя чуждом только для того, чтобы заглушить слишком тяжелые задушевные мысли.
Когда князь Мещерский уехал, князь Андрей взял под руку Пьера и пригласил его в комнату, которая была отведена для него. В комнате была разбита кровать, лежали раскрытые чемоданы и сундуки. Князь Андрей подошел к одному из них и достал шкатулку. Из шкатулки он достал связку в бумаге. Он всё делал молча и очень быстро. Он приподнялся, прокашлялся. Лицо его было нахмурено и губы поджаты.
– Прости меня, ежели я тебя утруждаю… – Пьер понял, что князь Андрей хотел говорить о Наташе, и широкое лицо его выразило сожаление и сочувствие. Это выражение лица Пьера рассердило князя Андрея; он решительно, звонко и неприятно продолжал: – Я получил отказ от графини Ростовой, и до меня дошли слухи об искании ее руки твоим шурином, или тому подобное. Правда ли это?
– И правда и не правда, – начал Пьер; но князь Андрей перебил его.
– Вот ее письма и портрет, – сказал он. Он взял связку со стола и передал Пьеру.
– Отдай это графине… ежели ты увидишь ее.
– Она очень больна, – сказал Пьер.
– Так она здесь еще? – сказал князь Андрей. – А князь Курагин? – спросил он быстро.
– Он давно уехал. Она была при смерти…
– Очень сожалею об ее болезни, – сказал князь Андрей. – Он холодно, зло, неприятно, как его отец, усмехнулся.
– Но господин Курагин, стало быть, не удостоил своей руки графиню Ростову? – сказал князь Андрей. Он фыркнул носом несколько раз.
– Он не мог жениться, потому что он был женат, – сказал Пьер.
Князь Андрей неприятно засмеялся, опять напоминая своего отца.
– А где же он теперь находится, ваш шурин, могу ли я узнать? – сказал он.
– Он уехал в Петер…. впрочем я не знаю, – сказал Пьер.
– Ну да это всё равно, – сказал князь Андрей. – Передай графине Ростовой, что она была и есть совершенно свободна, и что я желаю ей всего лучшего.
Пьер взял в руки связку бумаг. Князь Андрей, как будто вспоминая, не нужно ли ему сказать еще что нибудь или ожидая, не скажет ли чего нибудь Пьер, остановившимся взглядом смотрел на него.
– Послушайте, помните вы наш спор в Петербурге, – сказал Пьер, помните о…
– Помню, – поспешно отвечал князь Андрей, – я говорил, что падшую женщину надо простить, но я не говорил, что я могу простить. Я не могу.
– Разве можно это сравнивать?… – сказал Пьер. Князь Андрей перебил его. Он резко закричал:
– Да, опять просить ее руки, быть великодушным, и тому подобное?… Да, это очень благородно, но я не способен итти sur les brisees de monsieur [итти по стопам этого господина]. – Ежели ты хочешь быть моим другом, не говори со мною никогда про эту… про всё это. Ну, прощай. Так ты передашь…
Пьер вышел и пошел к старому князю и княжне Марье.
Старик казался оживленнее обыкновенного. Княжна Марья была такая же, как и всегда, но из за сочувствия к брату, Пьер видел в ней радость к тому, что свадьба ее брата расстроилась. Глядя на них, Пьер понял, какое презрение и злобу они имели все против Ростовых, понял, что нельзя было при них даже и упоминать имя той, которая могла на кого бы то ни было променять князя Андрея.
За обедом речь зашла о войне, приближение которой уже становилось очевидно. Князь Андрей не умолкая говорил и спорил то с отцом, то с Десалем, швейцарцем воспитателем, и казался оживленнее обыкновенного, тем оживлением, которого нравственную причину так хорошо знал Пьер.
В этот же вечер, Пьер поехал к Ростовым, чтобы исполнить свое поручение. Наташа была в постели, граф был в клубе, и Пьер, передав письма Соне, пошел к Марье Дмитриевне, интересовавшейся узнать о том, как князь Андрей принял известие. Через десять минут Соня вошла к Марье Дмитриевне.
– Наташа непременно хочет видеть графа Петра Кирилловича, – сказала она.
– Да как же, к ней что ль его свести? Там у вас не прибрано, – сказала Марья Дмитриевна.
Министерство Образования и Науки РФ
Казанский Государственный Технологический Университет
Кафедра ТООНС
Контрольная работа по курсу:
«Основы технологии органического синтеза»
Этиленгликоль
Введение
Физические свойства
Химические свойства
Способы получения этиленгликол
Технологическая схема получения этиленгликоля гидратацией окиси этилена
Технологическая схема совместного получения этиленгликоля и окиси этилена в стационарном слое катализатора
Применение этиленгликоля
Список литературы
Введение
Этиленгликоль - простейший двухатомный спирт ряда гликолей, впервые синтезированный Вюрцем в 1859 г. В промышленных масштабах эти-ленгликоль начали получать в Германии в период первой мировой войны. В настоящее время этиленгликоль (а также диэтиленгликоль и полиэтиленгликоли) вырабатывают в очень больших количествах и используют в различных отраслях народного хозяйства.
Будучи весьма гигроскопичным, этиленгликоль в то же время хорошо растворяет смолы, красители и некоторые вещества растительного происхождения. Благодаря сочетанию этих свойств этиленгликоль применяется при крашении тканей, в ситцепечатании, для приготовления штемпельных красок и косметических препаратов, для увлажнения табака и т. д. Этиленгликоль является также важным полупродуктом в производстве синтетических смол, растворителей, взрывчатых веществ и пр.
Состав этиленгликоля: С 2 Н 6 О 2 .
Структурная формула:
Н – С – С - Н
Физические свойства
Этиленгликоль СН 2 ОН-СН 2 ОН - вязкая бесцветная жидкость со слабым запахом и сладким вкусом. Температура кипения 197° С. Температуры кипения гликолей значительно выше температуры кипения спиртов, что является следствием усиления ассоциации молекул (образования водородных связей) из-за наличия в гликолях двух гидроксильных групп. Температура плавления -11,5° С. Плотность 1,11г/см 3 ; теплота парообразования 191 ккал/кг. Смешивается во всех отношениях с водой, глицерином, одноатомными алифатическими спиртами, ацетоном, ледяной уксусной кислотой, пиридином и фурфуролом; не смешивается с бензолом, ксилолом, толуолом, хлорбензолом, хлороформом, четыреххлористым углеродом. Этиленгликоль обладает токсическим действием, сходным с действием метилового спирта.
Этиленгликоль сравнительно устойчив при высокой температуре - не разлагается при пропускании над пемзой, нагретой до 400°С. Разложение гликоля начинается при 500 - 520°С, а при 550°С происходит уже со значительной скоростью; но даже при этой температуре до 36% этиленгликоля не подвергается разложению.
Важным свойством этиленгликоля является его способность сильно понижать температуру замерзания воды. Водный раствор, содержащий 40 объемных % этиленгликоля, замерзает при -25°С, а 60%-ный водный раствор при - 40°С. Поэтому этиленгликоль с успехом применяется для приготовления антифризов.
Химические свойства
Химические свойства этиленгликоля, как и других гликолей аналогичны свойствам одноатомных спиртов. Однако у гликолей могут вступать в реакции как одна, так и обе гидроксильные группы.
1. С щелочными металлами гликоли образуют полный и неполный гликоляты: CH 2 ONa - CH 2 ONa, CH 2 OH - CH 2 ONa.
Гликоляты образуются не только со щелочными металлами, но и с оксидами некоторых других металлов, например с гидроксидом меди. При действии щелочи на сульфат меди (II) образуется голубой осадок гидроксида меди (II). Этот осадок не растворяется в спирте, но очень легко на холоде растворяется в гликоле вследствие образования комплексного гликолята меди:
СН 2 ОН СН 2 - О О – СН 2 2 ׀ + Cu (OH) 2 →׀Cu׀ + 2 H 2 O СН 2 ОН СН 2 - О О – СН 22. С минеральными и органическими кислотами получаются полные и неполные эфиры. Например, в приведенной реакции образуются неполный и полный эфиры этиленгликоля и азотной кислоты - нитраты:
СН 2 ОН +НО NO 2 Н 2 О + ׀ _ СН 2 OH2HONO2 СН 2 ONO 2
СН 2 ОН 2Н 2 О + ׀Соответственно можно получить полные и неполные простые эфиры, например диэтиловый эфир этилен гликоля C 2 Н 5 ОСН 2 – СН 2 ОС 2 Н 5 и моноэтиловый эфир СН 2 ОН - СН 2 ОС 2 Н 5 . Последний под названием этилцеллозольв применяется как растворитель в производстве нитролаков, бездымного пороха (пироксилина), ацетатного шелка и других производных целлюлозы.
С двуосновными кислотами этиленгликоль ступает реакцию поликонденсации, образуя высокомолекулярные полиэфиры
HO – C = OOOН 2 С – ОН ׀ ׀׀ ׀׀
n ׀ + n R → – OCH 2 – CH 2 – O – C – R – C – + 2n H 2 O
Н 2 С – ОН ׀
HO – C = On3. Окисление гликолей проходит сложно, ступенчато:
О СН 2 OH – СООН → НООС – С - Н
СН 2 ОН ׀׀ ↓ ׀ → С О О СООНСН 2 ОН ׀ Н ׀׀ ׀׀ ׀
СН 2 OH С - С СООН4. Отщепление воды от этиленгликоля может иметь внутримолекулярный и межмолекулярный характер. Направление отщепления воды зависит от условий реакции. Пример внутримолекулярного выделения воды:
СН 2 ОН - СН 2 ОН → [СН 2 = СНОН] → СН 3 – СНО
Межмолекулярное выделение воды приводит к образованию оксиэфиров (спиртоэфиров) или циклических простых эфиров:
СН 2 – СН 2
СН 2 ОН НО – СН 2 СН 2 – О – СН 2 ׀ ׀
׀ + ׀ → ׀ ׀ → О О
СН 2 ОН СН 2 ОН СН 2 ОН СН 2 ОН ׀׀
СН 2 – СН 2
При межмолекулярной дегидратации этиленгликоля могут быть получены зависимости от условий диэтиленгликоль или диоксан:
СН 2 – СН 2
2НОСН 2 – СН 2 ОН → НОСН 2 – СН 2 –О-СН 2 – СН 2 ОН → О О
СН 2 – СН 2
Способы получения этиленгликоля
В промышленном масштабе этиленгликоль получают главным образом гидратацией окиси этилена:
Н 2 С – СН 2 +Н2О СН 2 ОН – СН 2 ОНПри гидратации окиси этилена, кроме этиленгликоля, образуются ди-, три-, тетра- и полиэтиленгликоли. Чтобы уменьшить образование полигликолей, гидратацию проводят с большим избытком воды (на 1 моль окиси этилена берут от 10 до 22 моль воды) и добавляют к водному раствору окиси этилена 0,1-0,5% кислоты. В этих условиях получается этиленгликоль, содержащий лишь немного диэтиленгликоля и следы высших полиэтиленгликолей.
Процесс проводят в жидкой фазе в присутствии катализаторов (небольшое количество кислоты - серной, фосфорной или щавелевой) при 50-100°С и атмосферном давлении или без катализатора - при 10 ат и 190-200° С.
Гидратацию окиси этилена при атмосферном давлении можно проводить, обрабатывая раствором кислоты контактные газы процесса прямого окисления этилена. Получаемый разбавленный раствор этиленгликоля нейтрализуют, отгоняют большую часть воды и далее фракционной перегонкой удаляют остатки воды и высшие гликоли.
В отсутствие катализаторов гидратацию окиси этилена проводят обычно под давлением 10 ат. при мольном соотношении окиси этилена и воды примерно 1: 16; продолжительность контакта 30 мин. Раствор гликолей упаривают в многокорпусном выпарном аппарате до содержания воды около 15% и далее подвергают ректификации. Соковый пар из последнего аппарата конденсируют и конденсат, содержащий 0,5-1,0% этиленгликоля, возвращают на гидратацию свежей окиси этилена. На 1 т этиленгликоля получается примерно 120 кг диэтиленгликоля и 30 кг триэтилен- гликоля.
Общий выход гликолей (считая на окись этилена) при получении их методом гидратации превышает 90%.
Этиленгликоль относится к классу многоатомных спиртов, причем это один из самых простых представителей полиолов. Химическая формула у него элементарная, поскольку в состав входит мало компонентов. Если вас интересуют более точные данные по вопросу “этиленгликоль, какой класс веществ”, мы ответим, что это двухатомный спирт и приведем формулу.
Как видите, в составе вещества всего три химических элемента и они находятся в предельно ясных “взаимоотношениях”.
Ну конечно, ответ на вопрос будет неполным, если мы не расскажем об основных физических и химических свойствах этиленгликоля. Это мы и спешим сделать.
Характеристики этиленгликоля
Это бесцветная жидкость без запаха, имеющая консистенцию сиропа, сладковатая на вкус, хотя пробовать ее настоятельно не рекомендуем, иначе не избежать серьезного отравления. Некоторые по незнанию хотят с ее помощью достичь состояния, подобного алкогольному опьянению, но такие эксперименты чреваты тяжелейшими состояниями.
Этиленгликоль ядовит. Принимать внутрь его нельзя. Смертельная доза, в зависимости от индивидуальной непереносимости, составляет от 50 миллилитров до 500 миллилитров, в среднем 100 миллилитров.
Этиленгликоль прекрасно растворяется в воде, спирте или ацетоне, плохо - в хлороформе или бензине. Принимает участие во всех химических реакциях, что и одноатомные спирты.
Вещество не горючее и слабо разлагается под воздействием света. Воспламеняется при температуре 124 градуса. Самовоспламеняется по достижении 380 градусов. Температура кипения - 197,3 градуса.
История и применение этиленгликоля
Это вещество впервые было получено в 1859 году французским химиком Шарлем Адольфом Вюрцем путем омыления диацетата этиленгликоля гидроксидом калия. Чуть позже применялись другие способы изготовления: добавление гидроксида к этиленгликольдиацетату и гидрирование этиленоксида.
Применение этиленгликоль нашёл не сразу. Впервые его начали производить на промышленном уровне только в 1917 году в США.
В 1929 году многие производители динамита стали активно использовать это вещество, а во время Первой мировой войны в Германии его применяли для изготовления взрывчатых веществ.
Сегодня этиленгликоль активно используют в автомобильной отрасли (антифризы, гидравлические жидкости), авиации, газодобывающей промышленности, в качестве энергоносителей. Современное производство нашло широкое применение простейшему многоатомному спирту, который легко получить в химической лаборатории. Качественный продукт всегда сбывают быстро.
Cодержание статьи: classList.toggle()">развернуть
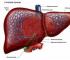
Этиленгликоль – одно из самых распространенных веществ, широко применяемых в быту и на производстве, относится к третьему классу опасности. Он входит в состав лаков и красок, средств бытовой химии, антифриза, пластмасс. Поэтому отравление этиленгликолем возникает довольно часто при нарушении правил его использования.
Этиленгликоль является токсичным веществом для организма, способным вызвать тяжелые отравления и даже смерть. По своей химической природе он относится к простым спиртам, без цвета и запаха, имеет легкую маслянистую консистенцию и сладковатый привкус. Это – еще один фактор, повышающий вероятность отравления. Поэтому очень важно предупредить интоксикацию и уметь правильно оказать первую помощь пострадавшему.
Где применяется этиленгликоль?
Область применения этиленгликоля в промышленности достаточно широка:
В домашних условиях ни по внешнему виду, ни по запаху распознать этиленгликоль и отличить его от аналогов нельзя, а только путем специальных химических реакций.
Как можно отравиться?
Этиленгликолем можно отравиться двумя способами:
- При вдыхании его паров;
- При употреблении внутрь;
- Через кожные покровы.
Попадание через дыхательные пути случается, как правило, на производстве в результате аварии , нарушения технологии производства и несоблюдения индивидуальных мер защиты. Этиленгликоль очень летуч, поэтому высокой концентрации в воздухе практически не создается, а отравления таким путем носят хронический характер – периодическое вдыхание небольших доз паров вещества.
 Другой, наиболее опасный и частый путь отравления – прием вещества внутрь.
Это может быть случайно, когда этиленгликоль хранится в бутылке из-под напитков, или оставлен в доступном для детей месте. Но чаще всего подобные отравления случаются с людьми с алкогольной зависимостью, которые умышленно принимают его для опьянения.
Другой, наиболее опасный и частый путь отравления – прием вещества внутрь.
Это может быть случайно, когда этиленгликоль хранится в бутылке из-под напитков, или оставлен в доступном для детей месте. Но чаще всего подобные отравления случаются с людьми с алкогольной зависимостью, которые умышленно принимают его для опьянения.
С этой целью его также получают в домашних условиях путем перегонки через аппарат-дистиллятор антифриза или тормозной жидкости. Отсутствие какого-либо запаха и сладковатый привкус вводят в заблуждение, что этот «аналог» этилового спирта не опасен, что и приводит к передозировке.
Попадание через кожные покровы встречается довольно редко, только при длительном прямом контакте с жидкостью, при этом интоксикация бывает не сильно выражена.
Влияние этиленгликоля на организм человека: вред и токсичность
Этиленгликоль, попадая в организм, распадается в печени, образуя токсические вещества с кислой реакцией (гликолевый альдегид, глиоксалат, оксалат кальция). Накопление этих продуктов распада нарушает кислотно-щелочное равновесие в тканях организма, вызывая состояние ацидоза – опасного состояния с нарушением метаболических процессов и угнетением всех функций.
Кроме этого, оксалаты оседают в тканях органов (головного мозга, легких, оболочках сердца, печени, почках, стенках сосудов, тканях глазного яблока), вызывая их повреждение. Оксалаты связывают ионы кальция, вызывая его дефицит в организме, что приводит к развитию судорог, параличей.
Токсичная доза, которая может вызвать серьезное отравление – от 20 мл (0,4 мл/кг), а смертельная доза составляет 2 мл/кг массы тела, то есть 100 мл и более. Эта доза может варьировать, в зависимости от состояния здоровья.
Для лиц, систематически употребляющих алкоголь и имеющих изменения в печени, тяжелое отравление может наступить и при небольшой дозе – до 40 мл. Первоначальный эффект «одурманивания» способствует потере контроля над количеством выпитого и появлению более тяжелых симптомов интоксикации, которая свидетельствует о поражении всего организма.
Симптомы отравления этиленгликоля
После приема внутрь этиленгликоля симптомы отравления появляются спустя 1-1,5 часа, когда он начинает всасываться из желудка. Клиническая картина сначала напоминает алкогольное опьянение, от которого можно отличить по отсутствию характерного запаха спиртного. От выпившего этиленгликоль едва ощутим сладковатый запах.
Неврологические проявления:
- Головокружение;
- Неадекватное поведение;
- Нарушение речи;
Похожие статьи

- Галлюцинации, эйфория;
- Заторможенность, сменяющая возбуждение;
- Мышечные судороги;
- Потеря сознания.
С поражением нервных центров связано появление глазных симптомов : двоение в глазах, подергивание век и глазного яблока, сменяющиеся неподвижностью. В тяжелых случаях развивается кома, которая заканчивается летальным исходом, если своевременно не оказана помощь.
 Со стороны органов пищеварения появляются тошнота, многократная рвота
, боли в животе, увеличивается в размерах печень. Страдают также почки: в моче появляется белок, кровь, снижается выделение мочи, развивается острая почечная недостаточность.
Со стороны органов пищеварения появляются тошнота, многократная рвота
, боли в животе, увеличивается в размерах печень. Страдают также почки: в моче появляется белок, кровь, снижается выделение мочи, развивается острая почечная недостаточность.
При хроническом отравлении парами этиленгликоля на производстве развивается сосудистая дистония («прыгает» давление), общая слабость, энцефалопатия (головные боли, раздражительность, плохой сон), а также поражаются глаза в виде сухости и воспаления оболочек.
Первая помощь и выведение вещества из организма
Алгоритм действий по оказанию помощи человеку, выпившему этиленгликоль или жидкость, его содержащую, таков:
- Вызвать бригаду скорой помощи;
- Промыть желудок содовым раствором (1 столовая ложка на 0,5 л воды);
- Давать обильное теплое питье: молоко, минеральная вода без газа;
- Дать выпить сорбент (активированный уголь, полисорб, энтеросгель);
- Дать слабительное, лучше всего подойдет магнезия.
Если пострадавший в сознании, и его состояние не тяжелое, хорошо дать выпить 100 мл водки или 50 мл медицинского спирта, разбавленного пополам с водой. Как это ни покажется странным, этиловый спирт является антидотом этого токсичного вещества, который можно применить в домашних условиях.
Если пострадавший без сознания, его нужно уложить на ровную поверхность , повернув голову набок во избежание асфиксии содержимым желудка в случае рвоты. Необходимо прощупать пульс и измерить давление. Пульс может быть нитевидным и даже не прощупываться на запястье, определять его нужно на сонных артериях – боковой поверхности шеи.
В случае остановки дыхания и отсутствия пульса нужно выполнить закрытый массаж сердца и принудительное искусственное дыхание.
В стационаре в качестве антидота при отравлении этиленгликолем вводится внутривенно стерильный щелочной раствор – бикарбонат натрия (сода), вводится глюконат кальция для восполнения его потери. Проводится восстановительная терапия, в зависимости от степени возникших нарушений. При тяжелом отравлении для очистки крови подключают аппарат гемосорбции (искусственная почка).
Последствия и осложнения отравления
К сожалению, последствия отравления этиленгликолем очень тяжелые. Около 40% больных, принявших его внутрь, погибают в течение 2-х недель.
Причиной летального исхода являются такие осложнения:

Не угрожающие жизни осложнения часто приводят к инвалидности. К таким последствиям относятся: атрофия зрительных нервов, потеря зрения, хроническая сердечная, почечная недостаточность, цирроз печени, поражение центральной нервной системы в виде бессонницы, астении и даже психических расстройств.
Этиленгликоль – это яд, о чем всегда нужно помнить. Категорически нельзя употреблять его внутрь в любом количестве, а в случаях воздействия его паров надо обратиться к врачу токсикологу, пройти обследование, лечение и принять меры профилактики.
ОБЩИЕ СВЕДЕНИЯЭмпирическая формула. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . С2Н6О2
Структурная формула. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . НОСН2 – СН2ОН
Молекулярная масса, кг/кмоль. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 62,1
Агрегатное состояние. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . жидкое
Внешний вид. . . . . . . . . . . . . . . . . . . . . . сиропообразная бесцветная жидкость
Запах. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . без запаха
Применение: используется в смеси с водой как антифриз; применяется в производстве пластмасс, искусственного волокна, используется в текстильной, парфюмерной, табачной и других отраслях промышленности.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Плотность при 20°С и давлении 101,3 кПа, кг/м3 . . . . . . . . . . . . . . . . . . . . . 1116
Плотность пара по воздуху. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2,14
Температура кипения, °С. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 197
Температура плавления, °С. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 12,3
Теплота сгорания, кДж/моль. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 1199,7
Удельная теплота сгорания, кДж/кг. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .19319
Теплота образования, кДж/моль. . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 453,8
Теплота плавления, ккал/моль. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2,78
Скрытая теплота испарения, кал/г. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 190,9
Константы уравнения Антуана в температурном интервале 53-198 °С:
А. . . . . . . . . . . . . . . . . . . . . . . . . . . . . 8,13754
В. . . . . . . . . . . . . . . . . . . . . . . . . . . . 2753,183
С. . . . . . . . . . . . . . . . . . . . . . . . . . . . 252,0094
Удельное объемное электрическое сопротивление, Ом?м. . . . . . . . . . 8,6?10-7
Диэлектрическая постоянная при 25°С. . . . . . . . . . . . . . . . . . . . . . . . . . . . . 37,7
: :Растворимость в воде: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . растворим
Реакционная способность: смешивается во всех соотношениях со спиртами, ацетоном, глицерином, ледяной уксусной кислотой, пиридином, фурфуролом. Нерастворим в ароматических углеводородах, хлороформе, четырех-хлористом углероде, хлорбензоле, сероуглероде. Мало растворим в эфире.
Этиленгликоль обладает всеми характерными свойствами гликолей. Со щелочами он образует соединения типа алкоголятов – гликоляты; с ионами меди (Cu2+) и т. п. – комплексные соединения. При окислении этиленгликоля получается смесь гликолевого альдегида СН2(ОН)СНО, гликолевой кислоты СН2(ОН)СООН, глиоксаля ОНССНО, глиоксалевой кислоты ОН-ССООН и щавелевой кислоты. С галогеноводородными кислотами этиленгликоль дает галогенгидрины, с соляной кислотой, например, этиленхлоргидрин; перегонкой с серной кислотой он превращается в диоксан, а действием азотной кислоты – в гликольдинитрат. При дегидротации образует ацетальдегид. Бурно реагирует с пентасульфидом фосфора; известны случаи взрыва этиленгликоля в смеси с 70%-ой перхлорной кислотой.
САНИТАРНО-ГИГИЕНИЧЕСКИЕ ХАРАКТЕРИСТИКИ
Регистрационный номер по CAS . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 107-21-1
Класс опасности в воздухе рабочей зоны. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3
ПДКм.р./с.с. в воздухе рабочей зоны, мг/м3 . . . . . . . . . . . . . . . . . . . . . . . . . . . 10/5
Код вещества, загрязняющего атмосферный воздух: . . . . . . . . . . . . . . . . 1078
ОБУВ в атмосферном воздухе. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1,000
Воздействие на людей: острое отравление парами маловероятно ввиду малой летучести этиленгликоля, а хронические возможны. При попадании через рот очень токсичен; действует главным образом на центральную нервную систему и почки (сосудистый и протоплазматический яд, вызывает ацидоз). Токсичен сам этиленгликоль и его метаболиты. Проникает через кожу.
Меры предосторожности: . . . . . . . . . . . . . . . . . . . . . . . . вытяжная вентиляция.
Средства защиты: . . . . . . . . . . . . . . респираторы или противогаз с фильтром.
ПОЖАРОВЗРЫВООПАСНЫЕ СВОЙСТВА
Группа горючести. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . горючая жидкость (ГЖ)
Температура вспышки, °С. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 111
Температура самовоспламенения, °С. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 410
Нижний концентрационный предел распространения пламени, %(об.) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4,3
Температурные пределы распространения пламени, °С. . . . . . . . . . 100-124
Средства пожаротушения: распыленная вода, воздушно-механическая пена.